多光子显微镜是进行生物医学组织成像的最重要的无标记技术之一,该技术具有亚微米水平的光学分辨率和光学切片的能力。多光子显微镜通过双光子激发荧光通常可以观察到单一的荧光蛋白、染剂或者内源性荧光团,但目前的方法较难实现多个不同荧光团的双光子激发。为了克服上述困难,目前的解决方案包括使用可调谐激光器调谐波长对不同的荧光团顺序成像,再将这些图像重合,或使用一个激光器激发具有重叠光谱的两个荧光团(SLAM)。然而,前一种方法由于成像过程需要切换波长很难实现快速成像,而且切换波长时无法保证样品完全不动,所以多个荧光团各自的图像可能无法完美重叠;后一种方法由于是单一激光波长激发荧光信号,所以不能对每个信号进行独立优化,无法使多个荧光团都被高效激发。
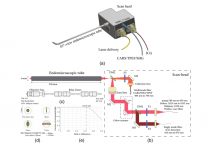
Pierre Mahou等人提出了一种对具有不同吸收光谱的两个或三个荧光团同时进行双光子成像的方法。如图1,他们通过同步来自飞秒光学参量振荡器 (OPO) 及其泵浦的脉冲序列,也就是将两束不同波长的激光同时和同空间的聚焦到样品上来实现三色激发 (λ1 (750–860 nm), λ2 (1000–1300 nm)),同步打入两束不同波长的激光时,除了泵浦光束λ1和OPO光束λ2分别激发蓝色荧光团和红色荧光团外,样品还能吸收一个λ1光子和λ2光子,然后产生一个荧光光子(图1c),相当于一个虚拟激发波长( λ3 = 2/(1/λ1 +1/λ2 )(850–1000 nm))激发绿色-黄色荧光团,该荧光即为双色双光子激发荧光。通过这种方式即可实现同时双光子激发蓝色、绿色-黄色和红色荧光团,并且可以独立控制它们的激发效率,其中单波长激发的蓝色荧光团和红色荧光团信号可直接通过调节其各自激发光的功率来调节其激发效率,双色双光子激发荧光则可以通过调节两束激光在时间上的延时来控制它的激发效率(图1d)。如图2,该组将该方案用于了活胚胎组织的实时三色双光子激发荧光和三倍频成像。

图1 使用同步脉冲的多色双光子成像原理[1]

图2 活胚胎组织的连续三色双光子激发荧光和三倍频成像[1]
除此之外,如图3,该组后续使用该技术实现了对内源性荧光团NAD(P)H 和 FAD的高效多色双光子荧光寿命成像。NAD(P)H 和 FAD是细胞中氧化还原反应的两个主要的辅酶,与能量产生和细胞代谢有关,NAD(P)H 和 FAD的荧光可以监测细胞的代谢活动,进而能非侵入性地监测干细胞分化、癌症发展和神经退行性疾病等过程。NADH 和 FAD 通常是在 750nm 和 880nm处依次被激发,这样成像速度慢且容易产生运动伪影,所以使用多色双光子成像的方法就可以避免这个问题,同时高效地激发NADH 和 FAD这两个荧光团。
总之,该组提出的多色双光子显微镜成像技术既可以同时激发多个基因编码的荧光团,观察神经元连接和细胞迁移等过程;也可以同时激发多个内源性荧光团,跟踪胚胎发育过程中形态和功能的变化,在生物成像领域有很广泛的应用前景。

图3 内源性荧光团的多色双光子荧光寿命成像原理[2]
参考文献:
[1] Mahou, P., Zimmerley, M., Loulier, K. et al. Multicolor two-photon tissue imaging by wavelength mixing. Nat Methods 9, 815–818 (2012).[2] Stringari, C., Abdeladim, L., Malkinson, G. et al. Multicolor two-photon imaging of endogenous fluorophores in living tissues by wavelength mixing. Sci Rep 7, 3792 (2017).