肿瘤微环境(TME)中还原性物种和氧化性物种之间的平衡在大多数生物过程中,尤其是凋亡细胞死亡过程中起着至关重要的作用。当氧化和还原分子的平衡被活性氧(ROS)浓度的增加打破时,癌细胞就会死亡,从而达到治疗肿瘤的目的。

核壳结构Au@CDs提出了一种光诱导增强氧化应激放大技术,可通过SERS技术有效用于肿瘤催化治疗。来源:Linjia Li,Jin Yang,Jiahui Wei,Chunhuan Jiang,Zhuo Liu,Bai Yang,Bing Zhao,Wei Song
目前,一些新的基于纳米酶催化的化学动力疗法和光动力疗法(PDT)方法被应用于肿瘤治疗领域,旨在实现肿瘤中原位催化生成ROS的效果。然而,大多数关于此类处理机理的研究仍然只关注纳米酶级联催化反应的结果,无法监控整个处理过程。
SERS是一种快速、无损的单分子检测技术,在监测细胞内相关生化反应方面具有巨大潜力。应用SERS技术监测肿瘤的光动力治疗过程有助于我们进一步了解纳米酶催化过程的具体机制,并可以揭示肿瘤微环境中氧化还原状态的具体信息。
在《Light:Science & Applications》杂志上发表的一篇新论文中,由吉林大学Wei Song教授、Zhuo Liu教授和Bing Zhao教授领导的一个科学家团队报告说,Au@CDs可用于肿瘤细胞的光动力治疗。SERS技术已用于识别整个PDT过程中TME中ROS的动态变化。光谱学是监测细胞内生化反应的最佳工具,具有较高的灵敏度。本研究对基于TME氧化应激损伤的PDT机制进行了深入研究,为肿瘤光疗的实时监测提供了有力的手段。
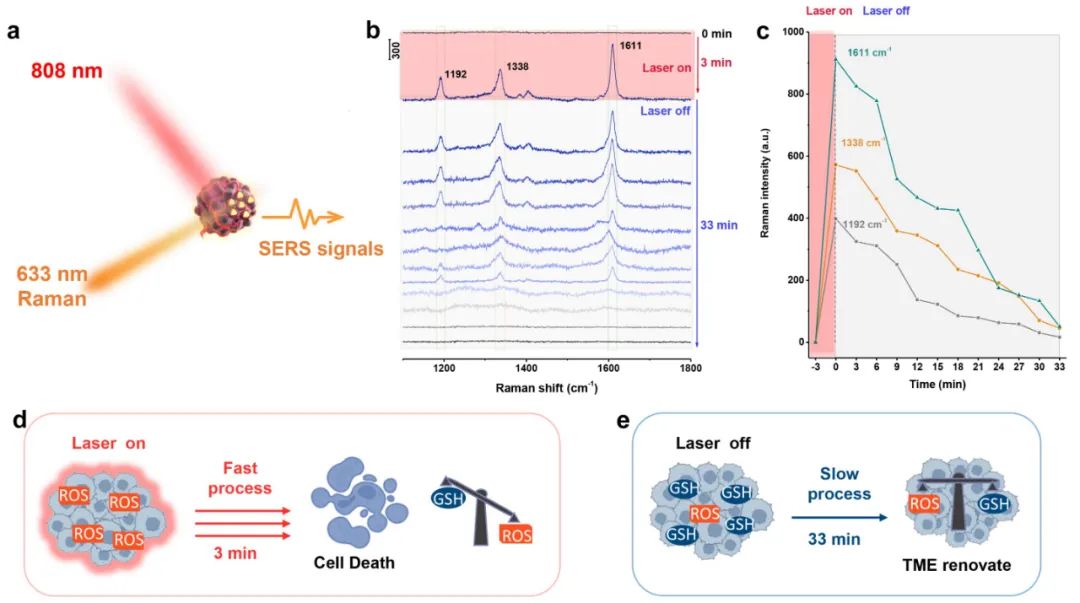
(a–c)肿瘤氧化应激过程中的依赖时间的SERS光谱和(d-e)TME氧化还原稳态的破坏和重新修复过程。来源:Linjia Li,Jin Yang,Jiahui Wei,Chunhuan Jiang,Zhuo Liu,Bai Yang,Bing Zhao,Wei Song
在近红外光的照射下,表面等离子体共振(SPR)激发的大量热载流子可以有效地参与反应,Au-NP的典型等离子体光热效应可以增强POD活性。此外Au@CDs介导谷胱甘肽(GSH)参与反应,加速活性氧的生成,呈现光热增强的光动力处理效应。这一级联纳米酶催化过程将迅速打破肿瘤中的氧化还原稳态,生成大量活性氧,并最终导致癌细胞凋亡。
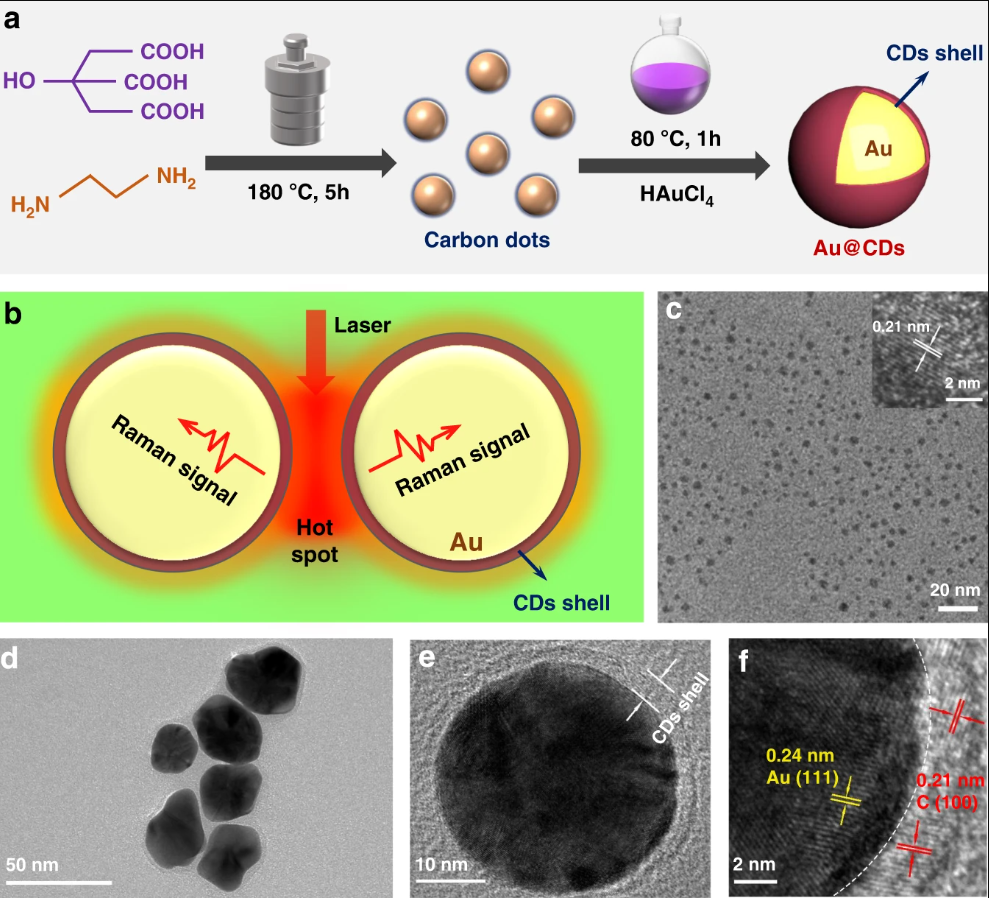
CD和Au@CDs.的形态学
SERS技术通过识别3,3,'5,5'-四甲基联苯胺(TMB)底物分子的氧化产物,用于监测光动力治疗过程中肿瘤微环境中ROS的动态变化。具体而言,在近红外激光照射下,PDT过程的光热性能增强效应可以在很短的时间内催化H2O2分解和GSH水平降低,进一步放大导致肿瘤消除的活性氧物种损伤。
随后,关闭NIR激光器后,oxTMB的信号在33分钟内减少,这与上述激光照射(3分钟)下的增加过程相比非常缓慢。这一结果进一步表明,TME中过度表达的还原剂(如GSH)将再次消耗过度表达的ROS,然后直到ROS活性被抵消和消除,氧化还原平衡状态将再次实现。
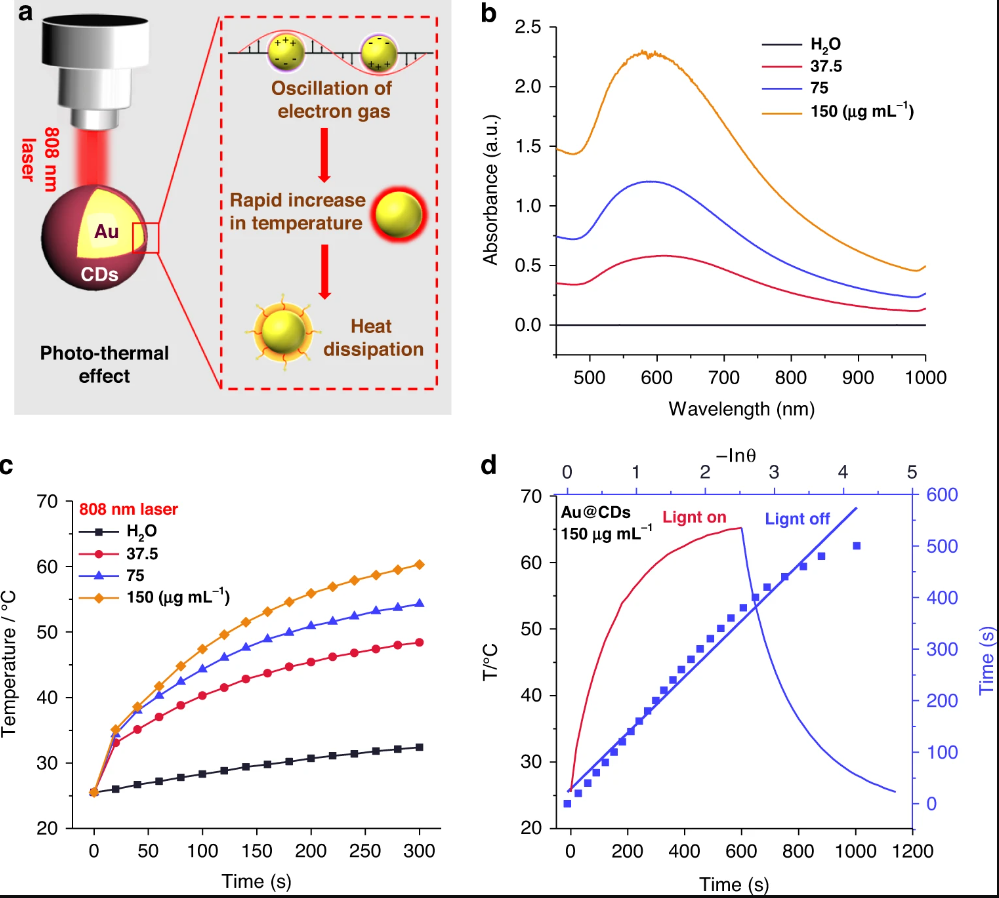
Au@CDs光热效果评价
此外,通过SERS策略,揭示了TMB中的完整氧化应激过程。这项关于反应机制的深入研究为实时监测肿瘤光疗和正常组织自我修复提供了最有价值的数据支持。




